|
Cultivo
Hidropônico de Plantas
Pedro Roberto
Furlani1 NUTRIÇÃO MINERAL DE PLANTAS, PREPARO E MANEJO DE SOLUÇÕES NUTRITIVAS
Ao contrário dos animais e microorganismos, os elementos químicos essenciais requeridos pelas plantas superiores são exclusivamente de natureza inorgânica. A identificação desses nutrientes atendeu aos critérios de essencialidade propostos por Arnon e Stout (1939), conforme citação de Resh (1996), ou seja: a) a deficiência ou a falta de um elemento impossibilita a planta completar o seu ciclo biológico; b) a deficiência é específica para o elemento em questão; c) o elemento deve estar envolvido diretamente na nutrição da planta quer seja constituindo um metabólito essencial, quer seja, requerido para a ação de um sistema enzimático. Dessa forma, com os elementos químicos carbono (C), hidrogênio (H), oxigênio (O), nitrogênio (N), fósforo (P), potássio (K), cálcio (Ca), magnésio (Mg), enxofre (S), boro (B), cloro (Cl), cobre (Cu), ferro (Fe), manganês (Mn), molibdênio (Mo) e zinco (Zn), uma planta é capaz de se desenvolver e completar seu ciclo biológico se as condições ambientais forem favoráveis. Com exceção dos nutrientes não minerais C, H e O, que são incorporados ao metabolismo vegetal, através da água e ar atmosférico, os demais nutrientes minerais são absorvidos via raízes. Recentemente, o níquel (Ni) entrou para o rol dos elementos essenciais por fazer parte da estrutura molecular da enzima urease, necessária para a transformação de nitrogênio amídico em mineral. Todavia a quantidade exigida pelas plantas deve ser inferior à de molibdênio.
Além desses nutrientes, outros elementos químicos têm sido esporadicamente considerados benéficos ao crescimento de plantas, sem contudo atender aos critérios de essencialidade. Como exemplo, podemos citar o sódio (Na) para plantas halófitas, o silício (Si) para algumas gramíneas e o cobalto (Co) para plantas leguminosas fixadoras de nitrogênio atmosférico.
De acordo com a redistribuição no interior das plantas, os nutrientes podem ser classificados em três grupos: móveis (NO3-, NH4+, P, K e Mg), intermediários (S, Mn, Fe, Zn, Cu e Mo) e imóveis (Ca e B). Essa classificação é muito útil na identificação de sintomas de deficiência de um determinado nutriente. Por exemplo, os sintomas de falta de N e de B, ocorrem em partes mais velhas (folhas velhas) e mais jovens da planta (pontos de crescimento), respectivamente.
Em cultivos hidropônicos, a absorção é geralmente proporcional à concentração de nutrientes na solução próxima às raízes sendo muito influenciada pelos fatores do ambiente, tais como: salinidade, oxigenação, temperatura, pH da solução nutritiva, intensidade de luz, fotoperíodo, temperatura e umidade do ar (Adams, 1992 e 1994).
Exigências Nutricionais de Hortaliças Visando o Cultivo Hidropônico
Quando se procede uma análise das exigências nutricionais de plantas visando o cultivo em solução nutritiva deve-se enfocar as relações existentes entre os nutrientes, pois essa é uma indicação da relação de extração do meio de crescimento. As quantidades totais absorvidas apresentam importância secundária uma vez que no cultivo hidropônico procura-se manter relativamente constante as concentrações dos nutrientes no meio de crescimento, diferente do que ocorre em solo, onde procura-se fornecer as quantidades exigidas pelas plantas através do conhecimento prévio das quantidades disponíveis existentes no próprio solo.
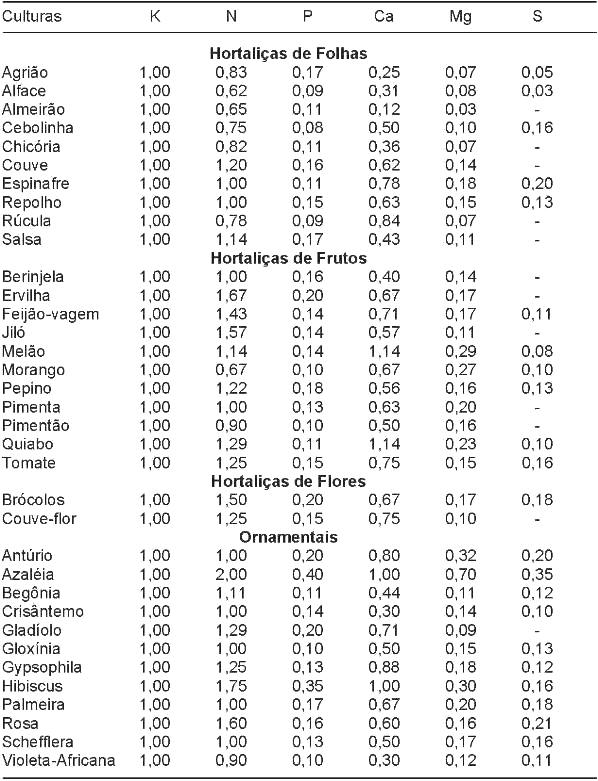
No quadro 1 são apresentadas as relações existentes entre os teores foliares considerados adequados de N, P, Ca, Mg e S com os de K para diferentes culturas passíveis de serem cultivadas no sistema hidropônico-NFT. Embora haja diferenças nos teores de nutrientes em folhas em função de cultivares, épocas de amostragem e posição das folhas, os valores apresentados indicam que existem diferenças entre essas relações para as diversas espécies considerando o desenvolvimento vegetativo adequado e que isto deve ser levado em consideração quando se utiliza uma única composição de solução nutritiva para o crescimento de variadas espécies vegetais. Quando isso ocorre com espécies que possuem relação de extração diferente, há uma grande possibilidade de desequilíbrio nutricional com o acúmulo e,ou, a falta de nutrientes ao longo do período de desenvolvimento das plantas, principalmente para plantas de ciclo mais longo, quando a solução nutritiva não é renovada integralmente. Os valores apresentados também indicam que para a reposição de nutrientes durante o desenvolvimento das plantas, essas relações devem ser consideradas.
Por exemplo, quando se usa uma única solução nutritiva para o crescimento de diferentes hortaliças de folhas, pode-se antever que as plantas de espinafre e rúcula irão absorver maiores quantidades de cálcio que as plantas de agrião, alface e almeirão, para cada unidade de potássio absorvido. Se isso não foi considerado na reposição de nutrientes, ocorrerá deficiência de Ca para essas culturas com maior capacidade de extração.
Por outro lado, para as culturas que possuem fase reprodutiva com interesse comercial seja na produção de flores ou de frutos, a relação entre N e K e P considerada deve ser diferente da usada para o desenvolvimento vegetativo. No período de floração e frutificação deve-se reduzir a relação N/K e aumentar P/K. Essas alterações são fáceis de serem feitas no cultivo hidropônico.
Composições de Soluções Nutritivas
A composição ideal de uma solução nutritiva depende não somente das concentrações dos nutrientes, mas também de outros fatores ligados ao cultivo, incluindo-se o tipo ou o sistema hidropônico, os fatores do ambiente, a época do ano (duração do período da luz), o estádio fenológico, a espécie vegetal e o cultivar em produção.
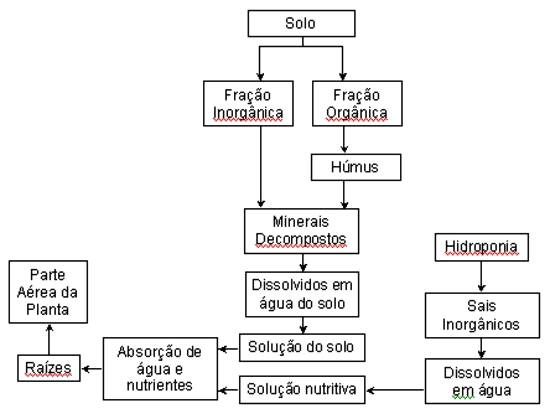
A figura 12, apresentada por Resh (1996), mostra as origens dos nutrientes no cultivo em solo e hidroponia. Comparando-se as composições químicas de extratos de solo e de soluções nutritivas, Martinez (1997) comentou que as maiores diferenças existentes entre esses dois meios de crescimento de plantas (solo e hidroponia) referem-se à concentração de P. Enquanto que na solução de um solo fértil ela é de 0,004 mmolL-1 (0,12 mgL-1), nas soluções nutritivas essa concentração mostra-se 125 a 675 vezes maior, isto é, entre 0,5 e 2,7 mmolL-1 (15 e 84 mgL-1). Segundo a autora, também o K e o N apresentam concentrações na solução do solo muito superiores às na solução nutritiva, sendo, respectivamente, de 49 a 126 vezes e de 16 a 56 vezes mais elevadas nessa solução. Para os demais nutrientes, as diferenças são de menor magnitude. A composição da solução de um solo apresenta muito pouca alteração em função da extração de nutrientes pelas plantas, uma vez que no solo, além da relação de volume de solução por volume de raízes ser muito elevada, também ocorre uma capacidade contínua de reposição de nutrientes a partir dos processos de decomposição e,ou, liberação dos componentes inorgânico e orgânico. Isso não ocorre com soluções nutritivas, onde normalmente, a relação de volume solução/raízes além de ser muito menor em relação às condições de solo, a reposição de nutrientes não existe de maneira natural.
Diversas soluções nutritivas já foram propostas na literatura havendo, em alguns casos, diferenças marcantes entre elas com relação às concentrações dos macronutrientes, enquanto que para os micronutrientes, as diferenças são bem menores. Hewitt citado por Benton Jones (1982), apresenta uma lista de 160 diferentes fórmulas, baseadas nos vários tipos de sais e combinações de fontes de N.
No entanto, é comum encontrar nos artigos a frase “solução nutritiva modificada de Hoagland”, isto é , fórmulas derivadas da proposta em 1938, por Hoagland & Arnon, conforme citação de Resh (1996), onde os valores expressos em (mgL-1) são : N-N03 (210), P(31), K (234), Ca (160), Mg (48), S (64), B (0,5), Cu (0,02), Fe (1,0), Mn (0,5), Mo (0,01) e Zn (0,05). Existe outra versão dessa solução com a adição de N-NH4 (14), mantendo-se o N total constante. Essa solução tem sido a mais usada em pesquisa com nutrição mineral de plantas e constitui-se a base para a formulação de inúmeras soluções nutritivas comerciais existentes em todo o mundo.
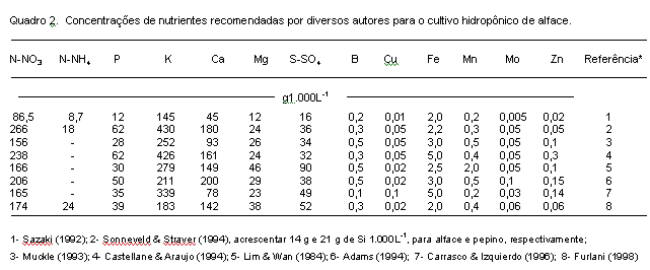
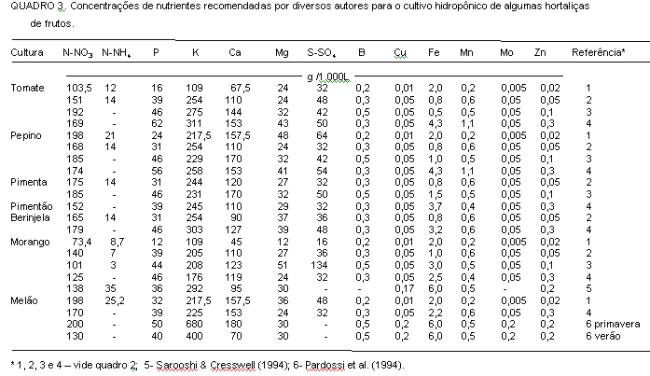
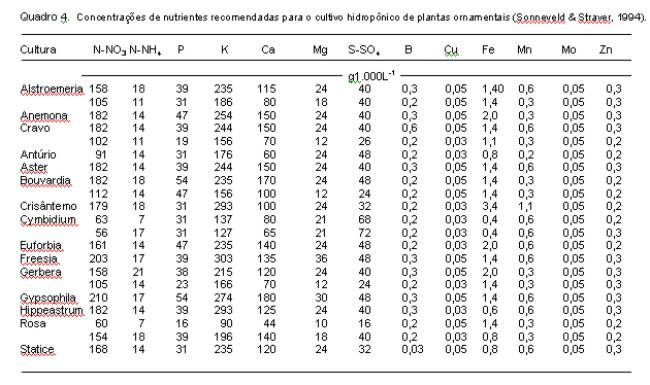
De maneira geral, segundo Barry (1996) as concentrações de nutrientes se apresentam nas seguintes faixas (mgL-1): N (70-250), P (15-80), K (150-400), Ca (70-200), Mg (15-80), S (20-200), Fe (0,8-6), Mn (0,5-2), B (0,1-0,6), Cu (0,05-0,3), Zn (0,1-0,5) e Mo (0,05-0,15). Esses valores podem ser observados nos quadros 2 a 4, nos quais estão apresentadas diferentes soluções nutritivas para várias espécies de hortaliças segundo propostas de diversos autores. Convém salientar que, para as condições em que foram avaliadas, todas apresentaram bons resultados, podendo-se dizer que não existe uma formulação que seja única e melhor que todas as outras. Como mencionado anteriormente, são pequenas as diferenças entre as concentrações de um mesmo micronutriente nas diferentes soluções nutritivas. Por exemplo, nas soluções propostas por Yamazaki, conforme citação de Sazaki (1992), as concentrações dos micronutrientes são as mesmas, independente da cultura.
Também já existem no mercado brasileiro, formulações importadas na forma de cristais e prontas para o uso, tais como: Kristalon® Laranja® 6-12-36 (adiciona-se Tenso-cocktail®), Plant Prod® 7-11-27, Peter’s Professional Hydro-Sol® 5-11-26. Estes produtos não contém Ca, o qual deve ser adicionado na forma de nitrato, sendo que o mais usado é o nitrato de cálcio Hydro® especial.
Preparo e Manejo Químico da Solução
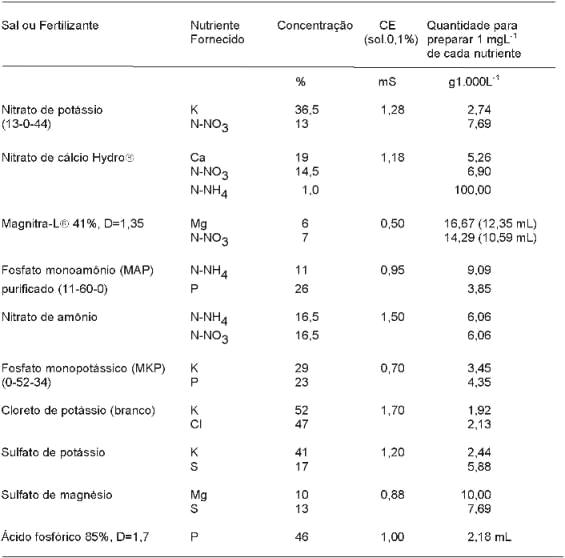
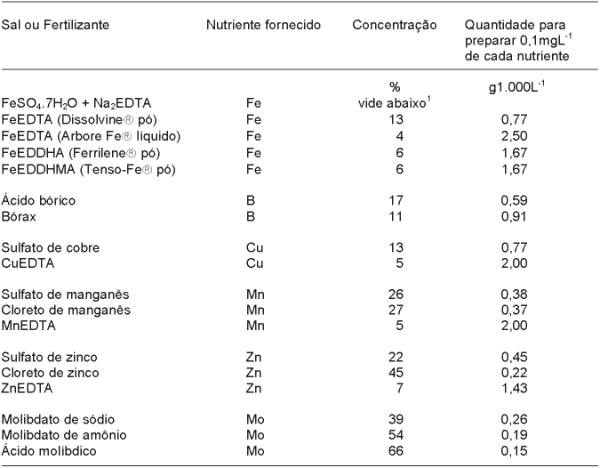
Os produtores que optarem pelo preparo de sua própria solução nutritiva, podem utilizar qualquer sal solúvel, desde que forneça o nutriente requerido e não contenha elemento químico que possa prejudicar o desenvolvimento das plantas. Nos quadros 5 e 6 encontram-se listados os sais/fertilizantes comumente usados para o preparo de soluções nutritivas. Alguns cuidados devem ser observados no preparo das soluções nutritivas destinadas à produção comercial: a) conhecer a qualidade da água, quanto ao suas características químicas (quantidades de nutrientes e concentração salina) e microbiológicas (coliformes fecais e patógenos). Se os teores de macro e micronutrientes forem respectivamente maiores que 25% e 50% dos valores da fórmula, as quantidades devem ser recalculadas; b) observar a relação custo/benefício e solubilidade na escolha dos sais fertilizantes; c) o nitrogênio na forma amoniacal (NH4+) não deve ultrapassar mais do que 20% da quantidade total de N da formulação; d) evitar a mistura de solução concentrada de nitrato de cálcio com sulfatos e fosfatos, pois podem ocorrer a formação de compostos insolúveis (precipitados) como sulfato de cálcio e fosfato de cálcio; e) dar preferência ao uso de molibdato de amônio ou ácido molíbdico em vez do molibdato de sódio, pois este é muito alcalino e quando adicionado ao coquetel dos demais sais de micronutrientes pode ocasionar precipitações de alguns deles.
Uma grande parte das soluções nutritivas não tem capacidade tampão, dessa forma o pH varia continuamente, não se mantendo dentro de uma faixa ideal. Variações na faixa de 4,5 a 7,5 são toleradas, sem problemas ao crescimento das plantas. No entanto, valores abaixo de 4,0 afetam a integridade das membranas celulares e valores superiores a 6,5 deve-se ter atenção redobrada com possíveis sintomas de deficiência de Fe, P, B e Mn.
As variações de pH que ocorrem na solução nutritiva são reflexos da absorção diferenciada de cátions e ânions. Por exemplo, quando o N é fornecido na forma nítrica, a absorção de ânions é maior que cátions ocorrendo elevação do pH. Por esta razão, recomenda-se o fornecimento de parte do nitrogênio também na forma amoniacal (NH4+), tornando a solução mais tamponada. É mais conveniente manter a solução nutritiva equilibrada em cátions e ânions para atender a demanda da planta, que tentar manter o pH numa faixa estreita de valores através do uso de ácido (sulfúrico, fosfórico, nítrico ou clorídico) ou de bases (hidróxido de sódio, de potássio ou de amônio) fortes para diminuir ou aumentar o pH do meio de crescimento, respectivamente. Convém salientar que o uso desses produtos deve ser feito com cautela, pois podem causar sérias queimaduras quando em contato com a pele e olhos do operador.
Considerando que a absorção de nutrientes pelas plantas é seletiva em função da espécie e do cultivar, a reposição dos nutrientes durante o desenvolvimento das plantas sem afetar o balanço entre as suas concentrações na solução nutritiva, passa a ser o maior desafio dos produtores hidropônicos.
Diferentes formas de reposição de nutrientes são mencionadas na literatura, de acordo com Berry (1996). Durante o desenvolvimento do cultivo hidropônico comercial, os sistemas de manejo foram também evoluindo. Inicialmente, procurava-se renovar periódicamente a solução nutritiva. Entretanto, essa prática ocasionava desperdícios com o conseqüente efeito poluente e, passou a ser substituída pela adição de sais proporcional ao volume de água consumido pelas plantas, usando como critério os valores da evapotranspiração. Este critério provocava aumentos nas concentrações de nutrientes extraídos em menores quantidades e deficiência dos nutrientes extraídos em maiores quantidades, se a solução nutritiva não fosse balanceada para a cultura. Embora sejam fáceis de usar na prática, estes critérios foram substituídos pelo controle da concentração salina da solução nutritiva mediante monitoramento com condutivímetro portátil. No entanto, a leitura fornecida pelo condutivímetro não discrimina os nutrientes, podendo também ocasionar desequilíbrios nutricionais. Para contornar esses problemas, a análise química periódica da solução nutritiva é a única maneira de repor à solução nutritiva, as quantidades de nutrientes que foram absorvidos pelas plantas. Do ponto de vista prático, exige-se que a análise seja feita de forma rápida e com custo baixo, o que nem sempre é conseguido por produtores residentes distantes de laboratórios de análises. Mais recentemente, esforços tem sido direcionados para o desenvolvimento de sensores que estimam a concentração dos nutrientes individualmente. Entretanto, nada definitivo e confiável existe no mercado brasileiro.
Para calcular as quantidades de sais ou de fertilizantes necessários para o preparo de qualquer uma das soluções nutritivas listadas nos quadros 2 a 4, pode-se multiplicar a concentração requerida do nutriente pela quantidade listada na quinta coluna do quadro 5 para se obter 1 mgL-1 de um determinado macronutriente, ou 0,1 mgL-1 de um micronutriente.
Também a condutividade elétrica (em mS) de qualquer solução nutritiva pode ser estimada à priori, somando-se os resultados da multiplicação da quantidade de cada sal pelo respectivo coeficiente de condutividade elétrica, conforme mostrado na quarta coluna do quadro 5, tomando-se o cuidado de transformar as quantidades em gL-1 para kg1.000 L-1.
Sugestão de Receitas para o Preparo de Soluções Nutritivas para Diversas Culturas em Hidroponia - NFT
a) Carrasco & Izquierdo (1996) - Hortaliças diversas (alface, manjericão, melão, tomate e pepino): Solução estoque A (g.100L-1): nitrato de cálcio (4.330); Solução estoque B (g100L-1): nitrato de potássio (8.295), nitrato de magnésio (3.270), fosfato monopotássio (MKP) (2.070), sulfato de potássio (3.665), quelato de ferro (FeEDTA-13% Fe) (400), Sequelene® (Mistura de micros: 1,6% Mn, 0,88% B, 0,8% Cu, 0,24% Mo e 1,12% Zn) (1,25). Para preparar 1.000 L de uma solução nutritiva com CE ao redor de 2,5 mS acrescentar 10 L de cada uma das soluções estoques ao reservatório e completar o volume com água. Para as diferentes espécies, usar a seguinte faixa recomendada de CE: alface (1,5 a 2,5 mS), manjericão (1,5 a 2,0 mS), melão (3,0 a 3,5 mS), pepino (3,0 a 3,5 mS) e tomate (2,5 a 3,0 mS).
b) Resh (1993) – Tomate – Solução estoque A1 (g100L-1): nitrato de cálcio (4.600); Solução estoque B1 (g100L-1): nitrato de potássio (2.300), fosfato monopotássico (1.800), sulfato de potássio (1.600) e sulfato de magnésio (2.000); Solução estoque A2 (g.100L-1): nitrato de cálcio (6.900); Solução estoque B2 (g.100L-1): nitrato de potássio (1.900), fosfato monopotássico (2.500), sulfato de potássio (3.900) e sulfato de magnésio (3.300); Solução estoque A3 (g100L-1): nitrato de cálcio (9.200); Solução estoque B3 (g.100L-1): nitrato de potássio (3.100), fosfato monopotássico (2.900), sulfato de potássio (5.000) e sulfato de magnésio (4.500); Solução estoque C (g100L-1): ácido bórico (17), sulfato de manganês (32), sulfato de cobre (2,8), sulfato de zinco (4,5), molibdato de sódio (1,3), quelato de ferro (10%Fe) (300). As soluções estoques com índices 1, 2 e 3 referem-se, respectivamente, aos estádios de crescimento 1- pós-emergência até primeira folha verdadeira, 2 – da primeira folha verdadeira até aparecimento dos primeiros frutos com 0,5 a 1,5cm de diâmetro, e 3- desta fase em diante até o final do ciclo. A solução estoque C (micronutrientes) é a mesma para os três estádios. Para preparar 1.000 L de solução nutritiva para uso nas três distintas fases de desenvolvimento do tomateiro, acrescentar 10 L de cada uma das soluções estoques A, B e C ao reservatório e completar o volume com água.
c) Papadopoulos (1991) - Tomate - Solução estoque A (g100L-1): nitrato de cálcio (9.900), nitrato de potássio (6.600); Solução estoque B (g100 L-1): sulfato de magnésio (5.000), fosfato monopotássio (MKP) (2.700), Dissolvine® (FeEDTA-13% Fe) (300), sulfato de manganês (50), ácido bórico (20), sulfato de cobre (3), sulfato de zinco (3,5), molibdato de amônio (1). Para preparar 1.000 L de solução nutritiva com CE ao redor de 2,2 mS acrescentar 8 litros de cada uma das soluções estoques ao reservatório e completar o volume com água. Quando iniciar com uma cultura nova (transplante de mudas), preparar uma solução com CE igual a 1,5 mS e aumentar gradualmente a CE para 2,2 mS durante a primeira semana de crescimento.
d) Papadopoulos (1994) - Pepino - Solução estoque A: (g100L-1) nitrato de cálcio (4.400), nitrato de potássio (6.270), nitrato de amônio (500); Solução estoque B: (g100L-1) sulfato de magnésio (5.000), fosfato monopotássio (MKP) (220), Dissolvine® (FeEDTA-13% Fe) (100), sulfato de manganês (25), ácido bórico (9), sulfato de cobre (3), sulfato de zinco (3,5), molibdato de amônio (1). Para preparar 1.000 L de solução nutritiva com CE ao redor de 2,2 mS acrescentar 8 litros de cada uma das soluções estoques ao reservatório e completar o volume com água. Quando iniciar com uma cultura nova (transplante de mudas), preparar uma solução com CE igual a 1,5 mS e aumentar gradualmente a CE para 2,2 mS durante a primeira semana de crescimento.
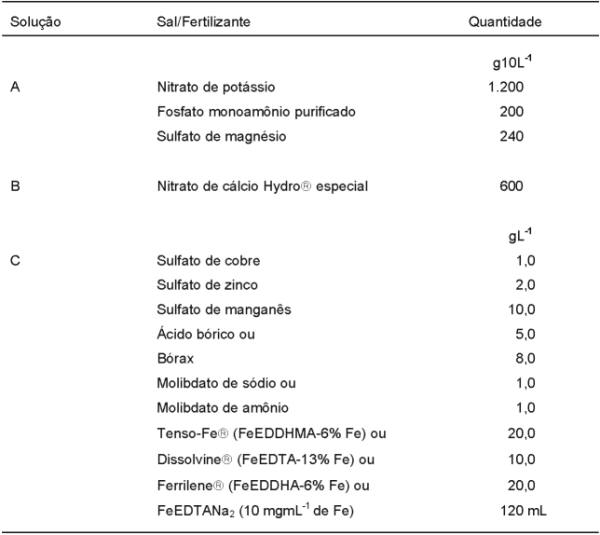
e) Furlani (1998) – Para diversas hortaliças de folhas - O Instituto Agronômico de Campinas tem uma proposta de preparo e manejo de solução nutritiva para cultivo hidropônico, destinada para diversas espécies de plantas e já utilizada por muitos produtores em escala comercial. O produtor pode preparar sua própria solução nutritiva utilizando sais ou fertilizantes simples, de maneira fácil e rápida. No seu preparo são usadas as quantidades de sais/fertilizantes, conforme consta do quadro 7 (Furlani, 1988). Com essas quantidades de sais, a solução nutritiva resultante teoricamente deve ter a composição apresentada no quadro 2 (Furlani, 1998). É importante salientar que a quantidade fornecida de N e P pode variar, dependendo da qualidade do fertilizante MAP (fosfato monoamônio), podendo-se optar entre o comum (22% de P) ou o purificado (26% de P). Devido às pequenas quantidades utilizadas, os micronutrientes podem ser fornecidos no preparo da solução inicial, através da alíquota de 100 mL de uma solução estoque contendo em um litro dez vezes as quantidades recomendadas de cada sal de micronutriente, com exceção do ferro que deve ser fornecido separadamente.
O manejo da solução nutritiva sugerido pelo Instituto Agronômico é baseado no trabalho de Nielsen (1984), que utiliza o critério da manutenção da condutividade elétrica, mediante a adição de soluções de ajuste com composições químicas que apresentam uma relação entre os nutrientes semelhante à extraída pela planta cultivada. A partir de dados da composição química de diversas hortaliças folhosas (quadro 1), Furlani (1998) sugere as formulações constantes dos quadros 7 e 8 para o preparo e manejo da solução nutritiva, respectivamente. Para preparar a solução nutritiva, dissolver cada sal separadamente e acrescentar ao depósito já contendo cerca de 900 L de água, cada uma das soluções concentradas e na ordem em que estão listadas no quadro 7. Após a adição da última solução concentrada, acrescentar água até atingir o volume de 1.000 L. Tomar a medida da condutividade elétrica. O valor da condutividade elétrica (CE) da solução nutritiva do IAC situa-se ao redor de 2,0 mS ou 2.000 µS ou 1.280 ppm ou 20 CF (1 mS = 1.000 µS; 640 ppm = 1.000 µS; 1CF = 100 µS). Pequena variação poderá ser encontrada em função da composição química da água usada para o seu preparo. No caso de se optar pelo uso de uma solução nutritiva com condutividade de 1,0 ou 1,5 mS ou 1.000 ou 1.500 µS (recomendado para o verão e para locais de clima quente - região Norte e Nordeste), basta multiplicar por 0,50 ou 0,75 os valores das quantidades indicadas dos macronutrientes, mantendo em 100% os micronutrientes.
. É conveniente que o volume do depósito
seja completado quantas vezes forem necessárias durante o dia para
evitar elevação muito grande na concentração salina da solução
nutritiva Para o manejo da solução durante a fase de desenvolvimento
das plantas seguir o seguinte procedimento:
O ajuste químico perfeito da solução nutritiva depende da cultivar, do ambiente de crescimento, da época do ano e principalmente da qualidade da água usada no cultivo hidropônico. Quando se procede a adição de água para repor as perdas por evapotranspiração, acrescentam-se também os nutrientes que estão presentes na água.
A água usada no cultivo hidropônico no Instituto Agronomico (IAC) tem apresentado a seguinte composição: 19 mgL-1 para Ca, 5 mgL-1 para Mg e 5 mgL-1 para K e 0,2S de CE. Isso indica que para cada 1.000 L de água reposta ao tanque, acrescentam-se também 19 g de Ca, 5 g de Mg e 5 g de K. Como consequência dessas adições ao longo do tempo para repor as perdas por evapotranspiração (o consumo médio de água num cultivo de alface hidropônica situa-se entre 75 e 100 mLplanta-1dia-1), poderá ocorrer desequilíbrio entre os nutrientes na solução nutritiva, com excesso de Ca e Mg em relação à K. Para contornar esse desequilibrio, deve-se proceder a análise química da solução nutritiva e efetuar as correções nos níveis dos nutrientes, ou então renovar a solução nutritiva quando as quantidades dos nutrientes acrescentados com a água atingirem valores maiores dos iniciais. A renovação da solução nutritiva também é recomendada para evitar aumento nas concentrações de materiais orgânicos (restos de plantas, exsudados de raízes e crescimento de algas) que podem servir como substrato para o desenvolvimento de microorganismos maléficos. Além disso, quando a água usada para o cultivo hidropônico apresentar CE entre 0,2-0,4 mS, há uma indicação que possui sais dissolvidos (carbonatos, bicarbonatos, Na, Ca, K, Mg, S, etc.) e com o tempo de cultivo e sua constante adição para repor as perdas evapotranspiradas, ocorrerá uma diminuição gradativa da CE efetiva dos nutrientes devido ao acúmulo de elementos indesejáveis.
Considerações Adicionais
Nos cultivos comerciais é comum ocorrer murchamento de plantas nas horas mais quentes do dia. Para contornar tal problema, é importante manter o nível do reservatório próximo da capacidade adotada, principalmente para as culturas de ciclo rápido, pois em decorrência da maior absorção de água e aumento de temperatura, a condutividade elétrica real pode aumentar no decorrer do dia e atingir valores críticos para as plantas. Para regiões de clima quente, este sintoma pode ser resultado de aumento na concentração de sais na solução nutritiva pois sabe-se que, proporcionalmente, as plantas absorvem mais água que nutrientes. Vale ressaltar que nestes locais é conveniente trabalhar com soluções mais diluídas. Outra causa do murchamento está relacionada com o apodrecimento do sistema radicular por patógenos e, ou, por falta de oxigênio na solução nutritiva, cujos sintomas iniciais causam escurecimento das raízes. Portanto, antes de qualquer decisão sobre a causa provável desse murchamento, o produtor deve procurar identificá-la corretamente. REFERÊNCIAS BIBLIOGRÁFICAS
ADAMS, P. Crop nutrition in hydroponics. Acta
Horticulturae, 323, p.289-305, 1992.
1
Eng°
Agr°,
Dr., Pesq.Cient./CSRA/Instituto Agronomico – Caixa Postal 28 –
CEP13001-970 Campinas, SP. Bolsista do CNPq. E-mail:
pfurlani@conplant.com.br
Dados para citação bibliográfica(ABNT): FURLANI, P.R.; SILVEIRA, L.C.P.; BOLONHEZI, D.; FAQUIN, V. Cultivo Hidropônico de Plantas: Parte 2 - Solução Nutritiva. 2009. Artigo em Hypertexto. Disponível em: <http://www.infobibos.com/Artigos/2009_2/hidroponiap2/index.htm>. Acesso em:Publicado no Infobibos em 06/05/2009 |